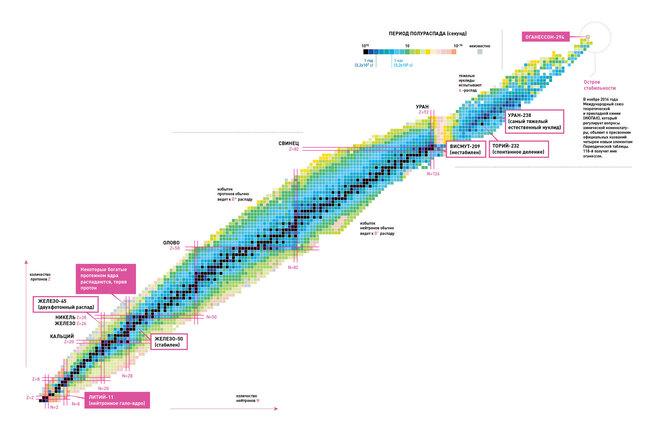
Límites da táboa periódica dos elementos. Onde está a feliz illa da estabilidade?
A táboa periódica dos elementos ten un límite "superior" - entón existe un número atómico teórico para un elemento superpesado que sería imposible de alcanzar no mundo físico coñecido? O físico ruso Yuri Oganesyan, de quen recibe o nome do elemento 118, cre que tal límite debe existir.
Segundo Oganesyan, xefe do laboratorio Flerov do Joint Institute for Nuclear Research (JINR) en Dubna, Rusia, a existencia dese límite é o resultado de efectos relativistas. A medida que aumenta o número atómico, a carga positiva do núcleo aumenta, e isto, á súa vez, aumenta a velocidade dos electróns arredor do núcleo, achegándose ao límite de velocidade da luz, explica o físico nunha entrevista publicada no número de abril da revista. . Novo Científico. "Por exemplo, os electróns máis próximos ao núcleo do elemento 112 viaxan a 7/10 da velocidade da luz. Se os electróns exteriores se achegasen á velocidade da luz, cambiaría as propiedades do átomo, violando os principios da táboa periódica", di.
Crear novos elementos superpesados nos laboratorios de física é unha tarefa tediosa. Os científicos deben, coa máxima precisión, equilibrar as forzas de atracción e repulsión entre partículas elementais. O que se necesita é un número "máxico" de protóns e neutróns que "se peguen" no núcleo co número atómico desexado. O propio proceso acelera as partículas ata unha décima parte da velocidade da luz. Hai unha pequena, pero non nula, posibilidades de formación dun núcleo atómico superpesado do número necesario. Entón, a tarefa dos físicos é arrefrialo o máis rápido posible e "captalo" no detector antes de que se degrade. Non obstante, para iso é necesario obter as "materias primas" adecuadas: isótopos de elementos raros e extremadamente caros cos recursos de neutróns necesarios.
Esencialmente, canto máis pesado sexa un elemento do grupo dos transactínidos, menor será a súa vida útil. O elemento con número atómico 112 ten unha vida media de 29 segundos, 116 - 60 milisegundos, 118 - 0,9 milisegundos. Crese que a ciencia alcanza os límites da materia fisicamente posible.
Non obstante, Oganesyan non está de acordo. Presenta o punto de vista de que está no mundo dos elementos superpesados. "Illa da estabilidade". "O tempo de desintegración dos novos elementos é extremadamente curto, pero se engades neutróns aos seus núcleos, a súa vida útil aumentará", sinala. "Engadir oito neutróns aos elementos numerados 110, 111, 112 e ata 113 prolonga a súa vida en 100 anos. unha vez".
Nomeado despois de Oganesyan, o elemento Oganesson Pertence ao grupo dos transactínidos e ten número atómico 118. Foi sintetizado por primeira vez en 2002 por un grupo de científicos rusos e estadounidenses do Joint Institute for Nuclear Research en Dubna. En decembro de 2015, foi recoñecido como un dos catro novos elementos polo Grupo de traballo conxunto IUPAC/IUPAP (un grupo establecido pola Unión Internacional de Química Pura e Aplicada e a Unión Internacional de Física Pura e Aplicada). O nomeamento oficial tivo lugar o 28 de novembro de 2016. Oganesson ma número atómico máis alto i maior masa atómica entre todos os elementos coñecidos. En 2002-2005, só se descubriron catro átomos do isótopo 294.
Este elemento pertence ao grupo 18 da táboa periódica, é dicir. gases nobres (sendo o seu primeiro representante artificial), con todo, pode mostrar unha reactividade significativa, a diferenza de todos os outros gases nobres. No pasado, o oganesson pensábase que era un gas en condicións estándar, pero as predicións actuais apuntan a un estado de agregación constante nestas condicións debido aos efectos relativistas que mencionou Oganessian na entrevista citada anteriormente. Na táboa periódica, está no bloque p, sendo a última raíz do sétimo período.
Tanto os estudosos rusos como os estadounidenses propuxeron historicamente nomes diferentes para el. Ao final, con todo, a IUPAC decidiu honrar a memoria de Hovhannisyan recoñecendo a súa gran contribución ao descubrimento dos elementos máis pesados da táboa periódica. Este elemento é un dos dous (a carón do seaborg) que recibe o nome dunha persoa viva.

